Was macht einen harmonisch schmeckenden Wein aus?
Neben den Aromen der Früchte ist es das Verhältnis von drei Faktoren: Der Restsüße im fertigen Wein, des Alkoholgehalts und der Säure. Es gilt die Faustregel: Je mehr ich von dem einen habe, desto höher sollte der Gehalt der beiden anderen Faktoren sein.
Ein Wein, der aufgrund der verwendeten Früchte sehr sauer ist, wird besser schmecken und ist besser verträglich für den Magen, wenn er etwas süßer ist. Und je höher der Säure- und der Alkoholgehalt des Weins ist, desto haltbarer ist er. Anders herum: Ein extrem säurearmer Wein schmeckt fade und nüchtern, er hat keinen Körper. Leider sind die wenigsten Früchte aufgrund ihres Säure- und Zuckergehalts ähnlich gut für die Weinbereitung geeignet wie die Weintraube.
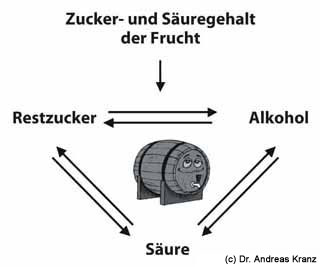
Abb. 6.1: Das Verhältnis von drei Faktoren bestimmt die Harmonie des Weins: Der Alkoholgehalt, der Restzucker und der Säuregehalt
Deshalb muss der Natur oftmals etwas nachgeholfen werden, um einen schmackhaften Wein aus anderen Früchten zu bereiten. Stellen Sie Sich vor, sie möchten einen schweren Dessertwein aus Bananen herstellen.Das ist ein sehr leckerer Wein, aber wenn Sie in eine Banane beißen, merken Sie natürlich sofort, das diese Frucht kaum Säure enthält. In den beiden folgenden Kapiteln werde ich Ihnen deshalb darstellen, wie man auch aus solch problematischen Früchten einen ausgewogen schmeckenden Wein mit einer gewünschten Restzuckermenge herstellen kann.
Bevor man die Zucker- oder die Säuremenge einstellen kann, muss man sie zunächst bestimmen können. Mit den dazu erforderlichen Techniken beschäftigt sich dieses Kapitel. Ich lege dabei besonderen Wert auf die Einfachheit der verwendeten Methoden, und ich möchte Ihnen auch vermitteln, warum die Methoden in ihrer Genauigkeit sehr begrenzt sind. Sie werden sehen, dass die Vorgehensweise viel unkomplizierter ist, als sie in vielen Büchern zur Weinbereitung dargestellt wird. Die Ergebnisse lohnen jedenfalls den Mehraufwand.
Wenn Sie meine Ratschläge in den nächsten beiden Kapiteln berücksichtigen, müssen Sie nur den Alkoholgehalt und die Säuremenge bestimmen. Der Vollständigkeit halber werde ich aber auch auf die Messung anderer Parameter eingehen.

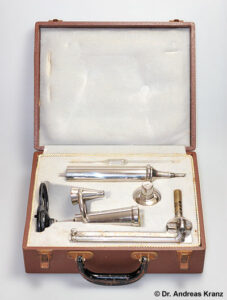
Abb. 6.2: Von links: Alkoholometer, Oechslewaage, Vinometer und Refraktometer
Die Messung des Zuckergehalts
Der Zuckergehalt kann mit zwei Geräten bestimmt werden: Mit einem Refraktometer und einer Oechslewaage. Mit dem Refraktometer wird der Brechungsindex der Flüssigkeit bestimmt, der von der Konzentration der darin gelösten Teilchen abhängt. Da ein Refraktometer aber mehrere hundert EUR kostet, kommt die Anschaffung für den Hobbywinzer kaum in Frage, weshalb ich nicht näher auf das Messprinzip eingehen möchte. Die Oechslewaage (Abb. 6.2) ist weit günstiger in der Anschaffung und soll deshalb genauer behandelt werden. Es handelt sich hierbei um eine Senkspindel, mit der die Dichte der Flüssigkeit in so genannten Oechslegraden bestimmt werden kann. Traditionell wird die Dichte des Weinansatzes (der Most) als Mostgewicht bezeichnet, die Oechslewaage wird deshalb manchmal auch Mostwaage genannt. Zur Bestimmung des Mostgewichts füllt man einen Messzylinder mit der zu messenden Flüssigkeit und lässt dann das Messgerät langsam hineingleiten, bis es frei schwimmt. Es muss senkrecht in der Flüssigkeit stehen und darf nicht die Wandung berühren. Das Gerät sollte außerdem sauber sein, und es dürfen sich keine Luftblasen an ihm befinden. Dazu muss ggf. die Kohlensäure im bereits gärendem Wein durch kräftiges Ausschütteln entfernt werden. Nach dem archimedischen Prinzip schwimmt ein Körper, wenn die Gewichtskraft des von ihm verdrängten Wassers seiner eigenen Masse entspricht. Da eine Zuckerlösung eine höhere Dichte als reines Wasser hat, wird die Oechslewaage umso tiefer eintauchen, je geringer die Dichte der Lösung ist, also je niedriger der Zuckergehalt ist. Der genaue Zuckergehalt wird an der Skala in der Höhe des Flüssigkeitsspiegels abgelesen. Wässrige Lösungen bilden einen so genannten „Meniskus“, d.h. die Flüssigkeit zieht sich am Glas nach oben. Die Ablesung kann nun „oben“ oder „unten“ erfolgen (Abb. 6.3). Normalerweise ist auf der Oechslewaage vermerkt, welches für Ihr Modell die richtige Ableseart ist. Findet sich kein Hinweis, so erfolgt die Ablesung immer „unten“. Man erhält eine Angabe in „Oechslegraden [°Oe]“: Dieser Wert gibt an, um wie viel schwerer ein Liter der gemessenen Flüssigkeit ist als ein Liter reines Wasser. Ein Liter eines Weinansatzes mit 50°Oe wiegt beispielsweise genau 1050 g. Je höher dieser Wert ist, desto süßer ist das Gemisch. Da die Dichte einer Flüssigkeit von ihrer Temperatur abhängt und die Oechslewaagen auf eine Temperatur von 20°C geeicht sind, muss der Messwert korrigiert werden, wenn die Temperatur der Flüssigkeit deutlich von 20°C abweicht. Für jeweils 3,5°C über 20°C werden 1°Oe addiert, für jeweils 3,5°C unter 20°C müssen 1°Oe abgezogen werden.
1°Oe entspricht einer Zuckermenge von etwa 2,6 g/l bzw. 0,26 Gewichtsprozent. Bei der vollständigen Vergärung einer Zuckermenge, die 10°Oe entspricht, entsteht etwa 10g/l Ethanol. Der Alkoholgehalt wird aber meist in Volumenprozent angegeben. Zur Umrechnung wird der Wert in Gewichtsprozent durch 7,9 geteilt (da Alkohol ein geringeres spezifisches Geweicht von 0,79 g/ml aufweist). Ein Weinansatz von 120°Oe bildet also maximal 120 g/l Ethanol, dies entspricht einer Menge von 15% Ethanol. Dies ist die absolute Obergrenze für den Zuckergehalt des Weinansatzes, denn die Alkoholtoleranz der meisten Hefen liegt unter diesem Wert. Enthält der Weinansatz mehr Zucker, so kann dieser nicht vollständig vergoren werden, und es entsteht ein Wein mit hohem Restzuckergehalt.
Im Kapitel „Der Zucker“ gehe ich näher auf die gebräuchlichen Einheiten zur Angabe des Zuckergehalts ein.
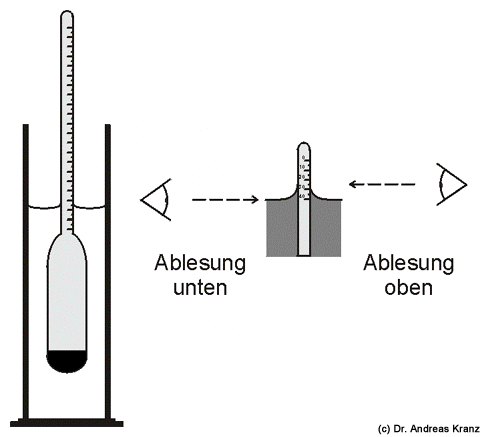
Abb. 6.3: Zur Bestimmung des Zuckergehalts soll die Oechslewaage frei in der Flüssigkeit schwimmen. Die Ablesung auf der Skala erfolgt entweder „unten“ oder „oben“.
Die Messung des Alkoholgehalts
Der Alkoholgehalt eines Weins kann mit verschiedenen Methoden exakt bestimmt werden, die aber für den Hobbywinzer nicht in Frage kommen. Es gibt zum Beispiel Kits zur Alkoholbestimmung, die auf der enzymatischen Umsetzung von Ethanol beruhen. Auch eine Destillation ermöglicht die exakte Ethanolbestimmung in einem Weinansatz.
Die dem Hobbywinzer zur Verfügung stehenden Methoden beruhen auf der Veränderung von physikalischen Eigenschaften in einem Wasser-Ethanol-Gemischs. Das Alkoholometer (Abb. 6.2) wird primär zur Bestimmung des Alkoholgehalts in Branntwein genutzt. Das Messprinzip beruht auf der Verringerung der Dichte einer alkoholischen Lösung, die mit einer Senkspindel bestimmt wird. Das Alkoholometer ähnelt der Oechslewaage, lediglich die Skala ist verschieden. Recht genau und einfach in der Anwendung ist das Vinometer (Abb. 6.2). Hierbei handelt es sich um ein Glasgerät mit einer Kapillare, an der eine Skala angebracht ist. Die Kapillare wird durch den kleinen Einfülltrichter mit Wein befüllt und mit dem Finger verschlossen. Anschließend wird das Vinometer auf eine ebene Unterlage gestellt und der Finger entfernt. Nun sinkt der Flüssigkeitspegel ab, wobei die Höhe dem Alkoholgehalt entspricht: Je höher der Alkoholgehalt, desto tiefer sinkt die Flüssigkeit. Dieser Effekt beruht auf der Adhäsionskraft des Wassers, die zum Beispiel bewirkt, dass Wassertropfen an Oberflächen hängen bleiben und erst herabstürzen, wenn die Gewichtskraft des Wassertropfens die Adhäsionskraft übersteigt. Alkohol besitzt geringere Adhäsionskräfte als Wasser, weshalb die Wassersäule von alkoholischen Lösungen im Vinometer tiefer sinkt. Auch die Messung mit dem Vinometer wird von der Temperatur beeinflusst und muss gegebenenfalls korrigiert werden. Der besondere Vorteil des Vinometers liegt darin, dass für eine Messung nur wenige ml Wein benötigt werden.
Da der Brechungsindex von Alkohol sich vom dem des Wassers unterscheidet, kann man den Alkoholgehalt auch mit speziellen Refraktormetern bestimmen, die eine Skala zur Ablesung des Alkoholgehalts haben.
Ein altehrwürdiges Messgerät für den Alkoholgehalt ist das Ebullioskop nach Vidal Malligand. Leider ist sehr teuer, der Neupreis liegt bei rund 600 Euro und ist damit für den Hobbywinzer leider zu teuer. Da es sich aber um ein ausgesprochen schönes Gerät handelt möchten wir es hier trotzdem vorstellen und das Messprinzip darstellen.
blank
Das Ebullioskop
Messprinzip und Aufbau
Können die Teilchen einer Flüssigkeit in einen gasförmigen Zustand übergehen, so kommt es zu einem ständigen Teilchenaustausch zwischen flüssiger und gasförmiger Phase. Dies hat zum Beispiel zur Folge dass Wasser auch bei niedrigen Temperaturen verdampfen kann. Der Dampfdruck ist hierbei ein Maß für das Bestreben der Teilchen, in den gasförmigen Zustand überzugehen. Der Dampfdruck hängt dabei von der jeweiligen Substanz ab und von der Temperatur. Eine Flüssigkeit siedet, wenn ihr Dampfruck dem Luftdruck entspricht. Wasser siedet zum Beispiel bei einer Temperatur von 100°C und dem „Normaldruck“ von 1013,25 hPa.
Alkohol hat einen höheren Dampfruck als Wasser, daher steigt der Dampfdruck eines Alkohol-Wasser-Gemischs mit steigendem Alkoholgehalt, dadurch sinkt der Siedepunkt der Flüssigkeit. Die Siedepunkterniedrigung gegenüber reinem Wasser ist daher ein Maß für den Alkoholgehalt. Auf diesem Zusammenhang beruht die Messung mit dem Ebullioskop (Abbildungen 6.A1 und 6.A2).
Das Ebullioskop besteht aus einem Probengefäß (P), in dem die zu testende Flüssigkeit mit Hilfe eines kleinen Spiritusbrenners (S) zum Sieden gebracht wird. Das Probengefäß ist mit einem Aufsatz verschlossen, in dem ein abgewinkeltes Thermometer (T) eingesetzt ist. Siedet die Probenflüssigkeit, so kondensiert die verdampfte Flüssigkeit in einem Kühler (K), von wo sie in das Probengefäß zurückläuft. Dadurch wird verhindert dass sich der Alkoholgehalt der Probe bei laufender Messung verändert. Das Thermometer verfügt über eine Skala, an welcher der Alkoholgehalt direkt abgelesen werden kann (Abbildung 6.A3).
- Abb. 6.A1: Ein Ebullioskop, zerlegt im Transportkoffer.
- Abb. 6.A2: Das einsatzbereite Ebullioskop. Es besteht aus einem Spiritusbrenner (S), einem Probenbehälter (P), einem Thermometeraufsatz (T) und einem Kühler (K).
- Abb. 6.A2: Das einsatzbereite Ebullioskop. Es besteht aus einem Spiritusbrenner (S), einem Probenbehälter (P), einem Thermometeraufsatz (T) und einem Kühler (K).
Die Durchführung einer Messung
Vor der ersten Alkoholmessung muss das Gerät zunächst auf die Siedetemperatur von reinem Wasser geeicht werden, die vom veränderlichen Luftdruck abhängig ist. Gehen Sie wie folgt vor:
- Das Probengefäß wird bis zum innen liegenden, unteren Füllstrich mit Wasser gefüllt, dann wird der Thermometeraufsatz aufgeschraubt.
- Der Spiritusbrenner wird entzündet. Über ein Rohr gelangt die Flüssigkeit aus dem Probengefäß direkt über die heiße Flamme.
- Sobald das Wasser hörbar siedet und sich der Quecksilberfaden des Thermometers nicht mehr bewegt wird die hinter der Skala liegende Fixierschraube gelöst. Die Skala wird nun so verschoben biss die Nullmarke genau am Ende des Quecksilberfadens liegt. Nun wird die Fixierschraube wieder angezogen und damit die Skala arretiert.
Nun ist das Gerät bereit für die eigentliche Alkoholbestimmung. Diese wird so durchgeführt:
- Das Probengefäß wird vollständig entleert und einmal mit dem zu messenden Wein gespült.
- Anschließend wird das Probengefäß bis zur zweiten, oberen Markierung mit dem Wein befüllt, dann wird das Probengefäß mit dem Thermometeraufsatz verschlossen.
- Der Kühler wird auf das Probengefäß geschraubt und mit kaltem Wasser befüllt.
- Nun wird der entzündete Brenner wieder in den Sockel gestellt, wodurch die Probe erhitzt wird.
- Das Ende des Quecksilberfadens wird beobachtet. Steht es still und kocht die Probe hörbar, so zeigt das Ende des Quecksilbers den Alkoholgehalt auf der Skala an.
Sollen mehrere Messungen direkt hintereinander durchgeführt werden, so ist keine erneute Bestimmung des Nullpunkts nötig. Das Kühlwasser sollte aber vor jeder weiteren Messung ausgetauscht werden.
Grenzen bei der Bestimmung von Zucker- und Alkoholgehalt
Vielleicht ist es Ihnen ja schon aufgefallen. Sowohl der Alkohol- als auch der Zuckergehalt bestimmen die Dichte der Lösung, und die Dichte muss für beide Bestimmungen herhalten. Das klappt gut, wenn eine Lösung entweder nur Alkohol oder nur Zucker enthält. Aber was passiert, wenn beides enthalten ist? Sie ahnen es sicher schon: Die Messungen werden zunehmend ungenau. Restzucker im Wein erhöht die Dichte, weshalb der Alkoholgehalt nicht mehr genau bestimmt werden kann. Auch das Vinometer versagt, sowohl Restzucker als auch das bei der Gärung gebildete Glycerin sowie Trübstoffe verändern das Verhalten der Flüssigkeit in der Kapillare. Zum Ende der Gärung hin sinkt der mit dem Vinometer gemessene Alkoholgehalt oft etwas ab.
Die oben beschriebenen Methoden liefern also nur dann verlässliche Werte, wenn der Ansatz zu Beginn der Gärung noch keinen Alkohol enthält, die Alkoholmessung ist erst im fertigen Wein mit wenig Trub, wenig Zucker und ohne Kohlensäure präzise.
Auch das Refraktometer versagt, denn der Brechungsindex, der mit dem Refraktometer bestimmt wird, wird sowohl von den gelösten Stoffen wie Zucker als auch vom Alkohol beeinflusst.
Dieses Problem kann umgangen werden, indem Sie mit einer kleinen Destille die gesamte Flüssigkeit einer Weinprobe verdampfen. Alkohol und Wasser werden so vom Restzucker getrennt. Danach können Sie den Alkoholgehalt des Destillats mit einer Senkspindel oder einem Vinometer genau bestimmen, denn er ist frei von Zucker. Wenn der feste Rückstand in der Destille wieder in Wasser gelöst wird, können Sie nun den Zuckergehalt genau messen, denn es ist kein Alkohol mehr vorhanden, der die Messung stört. Zu diesem Zweck gibt es kleine Destillen im Fachhandel, aber die sind recht teuer, und die Anschaffung lohnt sich meiner Meinung nach nicht für den Hobbywinzer.
Ein Weinansatz enthält noch andere Substanzen, welche die Dichte und damit insbesondere die Zuckermessung beeinflussen, so zum Beispiel die verschiedenen Fruchtsäuren oder die groben Fruchtreste zu Beginn der Gärung. Deshalb enthalten viele Bücher oder die Gebrauchsanweisungen der Oechslewaagen Tabellen, mit denen die gemessenen Werte fruchtspezifisch berichtigt werden können. Es sollte Ihnen jedoch klar sein, dass die so erhaltenen Werte keinesfalls genau sind.
Die Bestimmung der Säuremenge
Ein harmonisch schmeckender Wein benötigt eine bestimmte Säuremenge. Säurearme Weine aus Früchten mit einem geringen Gehalt an natürlichen Fruchtsäuren müssen deshalb mit Säure versetzt werden. Die aktuelle Säurestärke einer Lösung wird durch den pH-Wert (potentia Hydrogenii) beschrieben, der Werte zwischen 0 und 14 annehmen kann. Der pH-Wert ist der negative dekadische Logarithmus des Zahlenwerts der Konzentration der sogenannten Hydroniumionen [H3O+].
Das klingt jetzt sehr kompliziert, aber merken müssen Sie Sich nur das folgende:
- Säuren können Protonen [H+-Teilchen] auf Wasser [H2O] übertragen. Dabei entstehen Hydroniumionen [H3O+]
- Basen können Protonen aufnehmen. Sie neutralisieren also Säuren.
- Gibt eine Säure ein Proton ab, so entsteht aus dem Säureteilchen ein geladenes Teilchen, dass wieder ein Proton aufnehmen kann. Per Definition handelt es sich bei dem neu entstandenen Teilchen also um eine Base. Diese Base nennt man die zugehörige oder konjugierte Base der Säure (siehe Abb. 6.4 für ein Beispiel)
- Je höher die Konzentration an Hydroniumionen ist, desto saurer ist eine Lösung.
- Der pH-Wert gibt die Konzentration der Hydroniumionen an. Neutrales Wasser hat einen pH von 7, Lösungen mit einem pH von 0-6 sind sauer, Lösungen mit einem pH von über 7 sind basisch.
- Die pH-Skala ist logarithmisch. Deshalb ist z.B. eine Lösung mit einem pH von 3 zehnmal saurer als eine Lösung mit dem pH 4. Eine Lösung mit einem pH von 2 ist hundertmal saurer als eine Lösung mit dem pH von 4 usw.
Der pH-Wert eines Fruchtweins liegt meist zwischen 3 und 4. Er ist für die Weinbereitung jedoch von geringerer Bedeutung, denn er bestimmt den Säuregeschmack im alterersten Moment des Verkostens. Wichtiger ist die absolute Säuremenge, die in g/l angegeben wird, denn sie bestimmt die Nachhaltigkeit des Säuregeschmacks.
Nun haben mich einige Leser gefragt, warum man nicht vom pH-Wert direkt auf die Säuremenge schließen kann bzw. warum die Bestimmung der Säuremenge wichtiger ist als die Bestimmung des pH-Werts. Deshalb möchte ich etwas genauer auf diesen Punkt eingehen, bevor ich auf die Technik zur Säurebestimmung komme.
Eine Zelle und damit auch der „Fruchtmatsch“ im Wein besteht aus einem komplexen Gemisch aus verschiedenen schwachen Säuren, deren Basen, Proteinen und Salzen. Der pH-Wert einer solchen Lösung wird nicht von der absoluten Menge aller Bestandteile bestimmt, sondern von deren Verhältnis zueinander. Deshalb erlaubt der pH-Wert keinen Rückschluss auf die Säuremenge.
Dazu ein Beispiel mit Essigsäure. Die hier erklärten Prinzipien gelten uneingeschränkt für alle Säuren, die im Fruchtwein enthalten sein können. Wie Sie wissen, ist Essig sauer. Das liegt daran, dass das Essigmolekül ein Proton auf Wasser übertragen kann (Abb. 6.4). Dabei einsteht das Salz der Essigsäure. Das Salz der Essigsäure ist eine Base, denn sie kann wieder ein Proton aufnehmen: Die Abgabe des Protons vom Essig an Wasser ist reversibel.
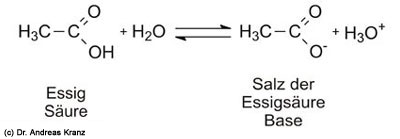
Abb. 6.4: Essig als Beispiel für eine Säure. Gibt die Säure ihr Proton ab, so entseht aus dem Säureteilchen die konjugierte Base.
Wenn der Hobbychemiker die schwache Säure Essig und ein Salz der Essigsäure (die konjugierte Base) so in Wasser mischt, dass das Verhältnis der Säure- und Basenteilchen 1:1 ist, so wird die Lösung einen pH-Wert von 4,74 haben. Das ist immer so, wenn ich diese beiden Stoffe im Verhältnis 1:1 mische. Es spielt dabei gar keine Rolle, wie viel Säure und Base er insgesamt in das Wasser gemischt hat.
Der pH-Wert ist also unabhängig von der Konzentration der Essigsäure. Andersherum gesagt: Wenn ich den pH-Wert messe, kann ich aus dem Ergebnis der Messung nicht auf die Gesamtkonzentration von Essig und seiner konjugierten Base rückschließen. Das ist der Grund, warum der pH-Wert eines Weinansatzes kein Maß für die Säuremenge ist.
Was für die Weinbereitung wichtig ist: Ein solches Gemisch aus schwachen Säuren und der konjugierten Base reagiert wie eine Pufferlösung, d.h. der pH-Wert wird innerhalb eines bestimmten Bereichs halbwegs konstant gehalten, auch wenn kleine Mengen Säure oder Base hinzu gegeben werden. Woran liegt das? Kommen wir auf unser Beispiel mit dem Hobbychemiker zurück, der einen Puffer aus Essig und der konjugierten Base des Essigs im Verhältnis 1:1 hergestellt hat. Gibt er z.B. ein klein wenig einer starke Base in diesen Puffer, so wird die Base Protonen aufnehmen, und die Konzentration der Hydroniumionen sinkt. Nun setzt die Pufferwirkung ein: Das Gleichgewicht zwischen Essig und der konjugierten Base verschiebt sich zugunsten des Salzes, d.h. einige Essigäureteilchen geben ihr Proton ab, bis der Verlust an Hydrioniumionen ausgeglichen ist. Deshalb bleibt der pH-Wert zunächst stabil bei 4,74. Erst wenn die Essigteilchen aufgebraucht sind steigt der pH-Wert bei Zugabe von Base an.
Je größer die Konzentration der Essigteilchen ist, desto später wird dieser Punkt erreicht. Eine höher konzentrierte Lösung „puffert“ also besser als eine niedrig konzentrierte, man muss umso mehr von einer starke Base zugeben, bis der neutralen Bereich (pH 7) erreicht wird, je höher die Konzentration des Puffergemischs ist.
Wie wir gesehen haben ist der pH ist kein Maß für die Säuremenge. Die Menge einer starken Base, die ich benötige, damit die Lösung einen neutralen pH erreicht, erlaubt hingegen den Rückschluss auf die Säuremenge. Eine solche Messung nennt der Chemiker Titration (siehe unten). Durch Titration kann die die Säuremenge auch im Wein bestimmt werden.
Noch ein Wort zur Nachhaltigkeit des Säuregeschmacks. Speichel ist ebenfalls ein Puffer, allerdings mit einem neutralen pH von etwa 7 bis 8 (ein niedriger pH würde verschiedene Enzyme im Speichel hemmen und den Zahnschmelz angreifen). Wenn Sie einen Schluck sauren Wein in den Mund nehmen, puffert Ihr Speichel quasi „gegen“ den pH-Wert des Weins. Ein Wein mit niedriger Säuremenge wird schneller vom Speichel neutralisiert als ein Wein mit hoher Säuremenge. Er schmeckt flau und langweilig. Ein Wein mit viel Säure ist nachhaltiger im Säuregeschmack, auch wenn der pH-Wert sich nicht von einem Wein mit geringer Säuremenge unterscheidet. Ein Zuviel an Säure schadet natürlich auch, die Säure kann feine Geschmacksnuancen überdecken und den Magen belasten. Erfahrungsgemäß sind Säurewerte von 7,5 g/l im Wein optimal.
Wie kann ich also die Säuremenge bestimmen? Durch Titration! Dazu dient das so genannte Acidometer. Das Prinzip beruht darauf, dass die Säure im Wein nach und nach durch Zugabe einer stark basischen Lösung neutralisiert wird. Die Säure ist vollständig neutralisiert, wenn der neutrale pH-Wert von 7 erreicht wird. Die Menge an Base, die man dafür benötigt, ist ein Maß für die Säuremenge, die im Wein ist. Das Erreichen des Neutralpunkts kann man durch den Umschlag eines farbigen Indikators erkennen.
Die Acidometer-Sets bestehen meist aus einem Messzylinder und der sogenannten Blaulauge. Die Blaulauge ist eine Lösung aus Natriumhydroxid (NaOH) mit dem Indikator Bromthymolblau, dieser ist im stark sauren Milieu rot gefärbt, im sauren Bereich gelb, bei ca. pH 6 schlägt er nach grün um und ab 7,5 ist die Farbe blau. Zunächst gibt man 10 ml Wein in den Messzylinder. Dann tropft man ein wenig Blaulauge in den Wein, und die Farbe schlägt nach gelb um, denn der Wein ist sauer. Nun tropft man langsam unter ständigem Mischen weiter Blaulauge hinzu, bis ein dauerhafter Farbumschlag des Indikators von gelb nach grün oder gar blau sichtbar wird. Nun hat man den neutralen pH-Wert von etwa 7 erreicht. Die dazu benötigte Menge Blaulauge kann man nun an der Skala des Messzylinders ablesen. Die Konzentration der Blaulauge ist so eingestellt, dass 1 ml verbrauchter Blaulauge einer Säuremenge von 1 g/l entspricht. Haben Sie also z.B. 5,5 ml Blaulauge bis zum dauerhaften Farbumschlag benötigt, so beträgt die Säuremenge im Wein 5,5 g/l.
Diese Sets haben zwei Nachteile: Erstens ist man von der Titrierlösung abhängig, die man (natürlich überteuert) nachkaufen muss. Zweitens bereiten extrem dunkle Weine Probleme, zum Beispiel aus Heidel- oder Holunderbeeren, denn man kann den Farbumschlag nur schwer beobachten. Außerdem ändern die meisten meisten Farbstoffe aus den Früchten während der Titration ebenfalls ihre Farbe. Rote pflanzliche Farbstoffe werden im basischen Bereich zum Beispiel oft blau. Hier kann man sich mit Lackmuspapier behelfen. Dieses Papier färbt sich im sauren Bereich rot, im basischen blau. Nach jeder Basenzugabe tropft man dazu etwas Lösung auf das Papier, welches die Flüssigkeit aufsaugt. Dabei bleiben die Farbstoffe des Weins in der Mitte des Tropfens zurück, und am Rand des Tropfens auf dem Papier kann der Farbumschlag beobachtet werden. Dies ist aber ein langwieriges Unterfangen.
Sie können sich die Titrierlösung, also die Blaulauge, auch selbst herstellen: Es handelt sich um eine 0,53 %ige NaOH-Lösung. Lösen Sie zur Herstellung 5,3 g NaOH in einem Liter Wasser und geben sie etwas Bromthymolblau hinzu. Beides ist im Chemikalienhandel preisgünstig zu beziehen. Achtung: NaOH ist eine sehr starke Base und führt zu Verätzungen! Gehen Sie nur mit NaOH um, wenn Sie mit den Sicherheitsbestimmungen vertraut sind! Benutzen Sie beim Umgang mit NaOH eine Schutzbrille! Vermeiden Sie den Kontakt mit der Haut oder den Augen! Sollte es trotzdem in die Augen gelangen, so spülen Sie sie mit viel Wasser aus und konsultieren Sie einen Augenarzt!
Inzwischen sind auch pH-Messgeräte für unter deutlich unter 50 Euro zu haben, und manch Aquarianer wird sowieso eines besitzen. Dann können Sie sich das Acidometer ganz sparen. Wichtig ist die Pflege und die regelmäßige Eichung dieser Geräte entsprechend der Hinweise in der Bedienungsanleitung. Stellen sie wie oben beschrieben eine 0,53%ige NaOH-Lösung her, jedoch ohne pH-Indikator. Entnehmen sie 10 ml Wein und geben sie etwas destilliertes Wasser oder notfalls auch Leitungswasser dazu, damit die Elektrode gut untertaucht (durch die Zugabe von neutralem Wasser ändert sich die Säuremenge in der Probe nicht). Tauchen Sie die Elektrode in die Flüssigkeit und geben Sie unter ständigem Rühren die NaOH-Lösung hinzu, bis das pH-Meter 7,0 zeigt. Besonders geeignet sind hierfür so genannte Büretten, die speziell zur Titration entwickelt wurden, oder 10 ml-Glaspipetten. Mit diesen Glasgeräten kann man die jeweils verbrauchte Menge Titrierlösung direkt ablesen. Auch hier gilt natürlich: Jeder Milliliter verbrauchter NaOH-Lösung entspricht einer Säuremenge von 1 g/l.
Ein weiteres sehr hilfreiches Gerät für die Titration ist ein Magnetrührer, ein spezielles Laborgerät zum Umrühren von Flüssigkeiten. Es nimmt Ihnen das ständige Mischen ab. Das Gefäß mit der Weinprobe wird auf den Magnetrührer gestellt, der einen ummantelten Magneten in der Probe in Drehung versetzt. Dadurch gerät die Flüssigkeit ebenfalls in Bewegung und mischt sich selbst ständig gründlich durch.
Lagerung und Haltbarkeit der Blaulauge
Das NaOH der Blaulauge kann bei langer Lagerung durch Kohlendioxid neutralisiert werden (NaOH + CO2 → NaHCO3); von überlagerter Blaulauge wird daher mehr Lauge zum Erreichen des Neutralpunkts benötigt, was einen hohen Säuregehalt vorgaukelt. Zudem kann sich der Indikator nach langer Zeit zersetzen. Gekaufte Blaulauge hat daher ein Haltbarkeitsdatum. Es empfiehlt sich, die Blaulauge oder die selbst angesetzte 0,53%ige NaOH-Lösung ohne Indikator in möglichst gasdichten Kunststoffflaschen aufzubewahren. Die Flaschen sollten nicht lange offen stehen, die Lösung altert zudem umso schneller, je leerer das Gebinde ist. Um die Güte einer Blaulauge zu testen kann man beispielseise eine Testlösung mit 10 g/l Zitronensäure ansetzen und diese titrieren. In der Praxis spare ich mir das und setze mir meine Lösung für jede Weinsaison einfach neu an.
Achtung: NaOH wird niemals in Glasflaschen gelagert, denn die Natronlauge reagiert auch mit Bestandteilen des Glases.
Die Bestimmung der gesamten schwefligen Säure
Das Schwefeln des Weins ist absolut zu empfehlen und gesundheitlich unbedenklich, wenn Sie nur die empfohlene Menge Kaliumpyrosulfit zum Schwefeln einsetzen. Dann ist es nicht notwendig, die vom Kaliumpyrosulfit freigesetzte Menge an schwefliger Säure zu messen. Ein übermäßiger Gebrauch des Sulfits kann zu einem „Schädelwein“ führen, dessen Genuss Sie am nächsten Tag bereuen werden.
Wenn Sie Essig aus selbstgemachtem oder gekauften Wein herstellen wollen, macht die Messung Sinn, da die Essigsäurebakterien sehr empfindlich auf hohe Konzentrationen der schwefligen Säure reagieren. Hierzu gibt es Titriersets, die in der Anwendung den Acidometern ähneln: Eine bestimmte Menge Wein wird zunächst mit einer Lauge und dann mit einer Säure versetzt und gut gemischt. Anschließend gibt man eine Iod-Iodid-Lösung hinzu, bis eine dauerhafte Blaufärbung eintritt. Diese wird durch eine Iod-Stärke-Einschlußreaktion hervorgerufen. Durch die schweflige Säure wird das Iod jedoch in Iodid umgewandelt, das mit der Stärke keinen farbigen Komplex bilden kann. Die benötigte Menge an zugegebenem Iod, die zu einer stabilen Blaufärbung führt, ist also ein Maß für die Menge der schwefliger Säure in der Weinprobe.
Ein antikes Messgerät zur Alkoholbestimmung: Das Liquometer
Das Vinometer ist sicher kein sonderlich beliebtes Messgerät. Ist die Kapillare verschmutzt oder enthält der Wein viel Trub oder viel Kohlensäure, so ist eine sinnvolle Messung fast unmöglich. Aber: Wer sich schon über das Vinometer aufregt sollte einen Blick auf das Liquometer werfen.
blank
Das Liquometer
Die älteste Erwähnung des Vinometers, die wir ohne aufwendige Suche haben finden können, stammt aus dem Jahr 1904. Bei dem Liquometer scheint es sich um einen Vorläufer des Vinometers zu handeln, welches in einer Fachzeitschrift für Analytik von 1867 beschrieben wird.
Messprinzip und Aufbau
Ebenso wie die Messung mit dem Vinometer beruht die Messung mit dem Liquometer mit der Fähigkeit einer Flüssigkeit, in Kapillaren aufzusteigen (Kapillarattraktion). Je höher der Alkoholgehalt einer Flüssigkeit, desto geringer ist die Kapillarattraktion. Durch die Ähnlichkeit zum Vinometer ist es keine Überraschung dass Faktoren, die die Vinometermessung beeinflussen, auch die Genauigkeit des Liquometers beeinträchtigen, also zum Beispiel die Visokosität der Flüssigkeit und die Temperatur.
Außer der eigentlichen Kapillare liegt noch ein kleines Brett bei, mit dessen Hilfe man die Kapillare exakt über der Testflüssigkeit positionieren muss.
- Abb. 6.B1: Ein Liquometer mit Transportbehälter. Es besteht aus einer Kapillare und einem kleinen Brett mit Bohrung.
- Abb. 6.B2: Das einsatzbereite Liquometer.
- Abb. 6.B3: Ein Blick auf die Skala verrät: Der Wein hat einen Alkoholgehalt von gut 14 %.
Die Durchführung einer Messung
Die originale Gebrauchsanweisung („Beschreibung des Verfahrens“) lautet wie folgt:
„In Fällen, wo man eine strenge Genauigkeit zu erhalten sucht, hat man folgende Vorschriften zu beachten: Man legt das Brettchen auf ein gewöhnliches Glas, welches man zu 3/4 mit der zu untersuchenden Flüssigkeit anfüllt.
Man faßt den Zylinder am oberen Ende an, setzt ihn in die in der Mitte des Brettchens befindlichen Oeffnung und drückt den Apparat nieder bis der Endpunkt (der Kapillare) 2-3 Millimeter in die Flüssigkeit kommt, dann saugt man am oberen Endpunkt leicht an, bis etwas von der Flüssigkeit in den Mund kommt, damit der Zylinder inwendig gehörig benäßt werde, hierauf zieht man den Zylinder soweit zurück, dass der Endpunkt nicht mehr eintaucht, dann läßt man ihn langsam wieder hineingleiten, bis die Spitze die Flüssigkeit berührt. Man bemerkt dies leicht, indem der Zylinder auf der Flüssigkeit sich spiegelt; berühren sich das Ende des Zylinders und sein Bild auf der Flüssigkeit, so stehen sie gleich.
Man saugt nun von neuem ein, aber so leicht, daß man keine Flüssigkeit in den Mund bekommt, dann verfolgt man mit den Augen die zurückgehende Flüssigkeitssäule, und der Punkt, wo dieselbe stille steht, giebt den Weingehalt an.
Gut ist es, die Operation ein- oder zweimal zu wiederholen, um sich von der Richtigkeit zu überzeugen.“